用于TAT的α-放射性核素的生产及供应

用于靶向α治疗的α-粒子
放射性核素的生产及供应
靶向放射性核素治疗已经取得了重要的临床突破,特别是源于前列腺特异性膜抗原-靶向和生长抑素受体-β-发射体(尤其是177Lu)靶向治疗的成功临床转化。α-发射放射性核素也成功地应用于研究和临床。Xofigo(223RaCl2;拜耳多菲戈)获得临床批准是基于α-发射体的放射性药物转化和应用的重要里程碑。
近日,在《核医学杂志》(The Journal of Nuclear Medicine)上发表了一篇综述,来自国际上20个放射性核素研究机构的专家团队合作探讨了目前临床实践中的候选药物(227Th/223Ra、225Ac、211At和212Pb/212Bi)以及正在进行临床前评估的几个候选药物(230U/226Th和149 Tb)的生产和供应现状。

▴Visual Abstract
NOTEWORTHY
TAT在临床癌症治疗中显示出巨大潜力。
限制TAT广泛应用的主要挑战之一是合适的TAT放射性核素的生产和供应。
对于大多数TAT放射性核素,目前的需求量远超现有的供应量,但国际上正在努力增加产量。
PART 1
临床实践中的候选药物
01
227Th/223Ra
从227Ac(t1/2,21.77 y)可提取用于TAT应用的2种核素:227Th(t1/2,18.7d)和223Ra(t1/2,11.43 d)(图1)。尽管它们的化学成分不同,但由于其共同的起始材料,它们被分为一类,类似于225Ac和213 Bi或224Ra和212Pb。

▴图1 227Ac的衰变方案
227Ac主要通过核反应堆中226Ra靶材的中子辐照产生,在生产中需要考虑与226Ra(t1/2,1600 y)作为靶材相关的高放射性、产生子体为放射性气体、数量有限等限制因素。226Ra靶照射后,下一步是使用液相色谱技术从靶材中提纯227Ac,分离过程需去除所有镭和钍。227Ac通常保存在稀硝酸溶液中,进行装运前将其干燥至硝酸锕。
227Th是从含有227Ac的发生器中获取的。使用分离柱把钍从锇和镭中分离出来,从而去除母核素和子核素。纯化后的钍可在现场用于立即标记或以氯化钍的形式运输至标记现场。如果装运或标记延迟,可重复去除镭的纯化步骤,以尽量减少子体的剂量贡献。
223Ra也可以从含有227Ac的发生器中获得。使用分离柱,镭可以从锕和钍中分离出来,从而去除两种母核素。纯化镭通常立即在现场用于药物配制,或作为干氯化镭运输。
镭是TAT的一个很好的候选药物,但在过去的几十年中没有找到合适的螯合剂。然而,223Ra的离子形式Xofigo在临床上被用作治疗骨转移性前列腺癌,该制剂并不包含螯合剂或靶向寻找部分。因此,Xofigo代表了TAT制药的一种特殊形式。Xofigo的使用和处理目前已在53个国家获得批准,构成任何后续TAT药物的基础,包括在欧盟、美国和日本生产的药物。Xofigo采用28天的异常长的保质期,部分原因是223Ra的t1/2,部分原因是放射性分解的影响较小,并且生产地点在全球分布。
对于研究应用,227Ac、227Th和223Ra的供应目前已经足够,但临床或商业用途的总体供应还不太确定,尚未有不同供应商生产能力的数据公布。
02
225Ac/213Bi
225Ac是最有潜力的TAT放射性核素之一,t1/2为9.92 d,衰变链中净发射4个α粒子。它可用于TAT放射性药物或作为213Bi的来源(t1/2,45.61 min),也可用于TAT。
225Ac有多种生产路线。两个最重要的方法:一是从含有233U的废物堆中获得的229Th的自然衰变中分离出来,虽为主要来源,但分离难度极高,可及性受限;二是用高能质子(>70 MeV)辐照232Th通过232Th(p,x)225Ac反应获得。225Ac最常从229Th发生器中生产,229Th是233U衰变系列中225Ac的母代同位素(图2),其t1/2为7917y。

▴图2 233U的衰变方案
目前,大部分225Ac以225Ac标记的放射性药物的形式使用,用于临床前开发和临床研究,主要集中在治疗前列腺癌、神经内分泌肿瘤和胶质瘤。尽管由225Ac/213Bi发生器产生的213Bi的应用也显示出巨大的临床效益,但目前高活性发生器的有限可用性和高成本阻碍了进一步研究。
03
211At
211At(图3)可能是最容易生产的α放射性核素,商业化放量潜力大。然而,目前它的可用性是有限的,因为世界上只有小部分加速器能产生具有最佳能量范围(28-29 MeV)和束流(10 mA或更高)的α光束,以产生足够数量的211At用以科学研究和临床应用。此外,211At的t1/2相对较短(7.21 h)造成了运输分配难题。因此,211At的供应模式是网状的,例如由DOE isotope(美国能源部同位素发展中心)建立的网络。

▴图3 211At的衰变方案
最常见的生产方法是使用209Bi(α,2n)211At反应,即用α粒子轰击金属铋靶材(图4)。廉价的天然同位素铋(纯度可达到99.999%)可以直接用于靶材制备。金属铋的熔点较低(272℃),因此需要有效的冷却方法来防止靶材在辐照过程中熔化。厚靶(80 mm)可以防止光束打在靶背,但薄靶可以被高效冷却。具有较高熔点的替代铋靶材料如Bi2O3可被用于辐照,但迄今为止还没有发现优于金属铋的材料生产211At。

▴图4 211At的直接和间接生产途径
与其他α-发射体相比,从辐照的铋靶中分离纯211At也相对简单,因为在最佳辐照条件(比如控制α射线的入射能量)下没有其他放射性核素产生。最常见的也许是最简单的分离211At的方法是高温(650 ℃-700 ℃)干馏。然而,挥发的211At可能存在辐射安全问题。因此,正在开发替代的湿化学分离方法。为了简化211At的分离,干馏和湿化学方法的自动化方法也正在开发。
目前211At的数量还不足以在临床上广泛使用。事实上,只有美国的杜克大学和华盛顿大学以及丹麦的哥本哈根大学医院已经生产出可用于临床试验的211At。
尽管211At的生产目前是有限的,但与生产其他α-发射体所需的高能加速器或核反应堆相比,可以以明显较低的成本增加具有中等能量α-束流的加速器。此外,加速器的技术革新以及新的靶材技术都有望提高211At的产量。
04
212Pb/212Bi
212Bi(t1/2,60.55 min)和212Pb(t1/2,10.64 h)都是232Th(t1/2,1.4× 1010 y)和232U(t1/2,68.9 y)衰变链的一部分,而212Bi是212Pb的衰变子代(图5)。212Pb通过衰变成稳定208Pb发射出2个β - 粒子和1个α粒子,而212Bi发射出1个β -粒子和1个α粒子,可用于靶向放射性核素治疗。这两种放射性核素都可以从228Th源中分离出来,它是232Th和232U的衰变子代。
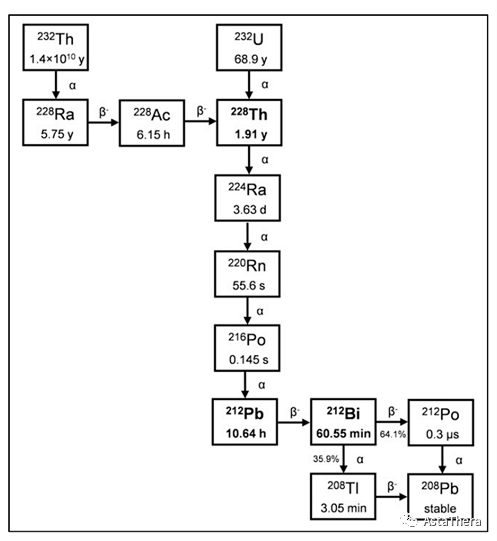
▴图5 232Th 和232U的衰变方案
临床上使用212Bi的一个主要缺点是其子体208Tl发射高能量的γ射线(212Bi每次衰变强度为2.6 MeV,36%)。这不仅导致发生器系统的放射性损坏而产生稳定性问题,并要求操作者进行严密的屏蔽。
在放射性药物开发中使用212Pb作为体内发生器,而不是直接使用212Bi,可以将治疗所需的药量减少10倍,并且其较长的t1/2有利于放射性药物的生产、配制和给药。然而,与讨论的其他α发射体类似,还需要考虑到β衰变后的子体反冲和随后的子体保留问题。
PART 2
临床前评估中的候选药物
在放射性同位素表中有几百种α-发射体;然而,大多数不适合用于TAT,因为它们的t1/2或在放射性药物生产和配制方面有困难。然而,随着替代性生产路线的出现和螯合系统的发展,另外几种可以用于TAT的α-发射体受到了关注。
230U/226Th 230U(t1/2, 20.8 d)可直接用于TAT,或作为寿命较短的226Th (t1/2, 30.57 min)的发生器。与225Ac/213Bi相比,230U/226Th一个潜在的优势是有多个α衰变,其子体寿命很短(几秒钟),这有可能防止子体从靶点衰变后出现明显的离域现象(图6)。以与225Ac相同的方式使用230U直接标记生物分子(如抗体或肽)的主要挑战之一是用于放射性药物的铀的螯合作用仍相对不发达。此外,对于230U/226Th发生器来说,226Th的t1/2较短,如果以与213Bi相同的方式使用,在物流和放射性药物合成方面可能是一个挑战。

▴图6 230Pa的衰变方案
149Tb 如果不包括那些t1/2极短(108Te)或极长(146Sm)的发射体,149Tb(t1/2,4.118 h)是最轻的α-发射体(图7)。149Tb能够在体外杀死单个癌细胞,并且是涵盖治疗和诊断中不同核医学模式的铽治疗四联体的一部分,因此被认为是一种具有潜在意义的α发射放射性核素。

▴图7 149Tb的衰变方案
总结与讨论
目前大多数TAT放射性核素的供应量都不足以进行临床前和临床评估。由于成本高或等待时间长,只有极少数研究小组能可靠地获得TAT放射性核素。因此,用于TAT的α射线核素的供应是一个迫切需要解决的问题。
▾表1 讨论中的TAT放射性核素的核性质及其目前的生产路线

以下几种策略有希望解决TAT放射性核素的供应短缺问题:
◎通过利用现有的基础设施或开发新的方法来开发替代生产策略;
◎改进靶向和放射化学分离策略,从而扩大TAT放射性核素的生产规模;
◎就临床前和临床应用中适当的放射性核素和放射化学纯度达成广泛共识;
◎开发各种不同的螯合和输送系统组合,以减轻α-发射体的物理和化学限制;
◎确定临床应用的剂量学和质量标准。
在为临床前、特别是临床TAT选择最合适的候选核素时,α-发射体的供应和生产至关重要。α-发射体的供应不足减缓了用于TAT放射性药物的成功开发。然而,一些里程碑式的发展,包括Xofigo和225Ac标记的前列腺特异性膜抗原配体的成功,彰显了TAT的巨大潜力。这些成功案例进一步激发了学术界和工业界的浓厚兴趣,预计放射性药物的供应很快将大大改善。


关于我们
砹尔法纽克莱(宁波)医疗科技公司成立于2020年11月,落地于浙江省宁波市杭州湾新区。我们专注于医用核素及核素药的生产研发,为疾病提供诊断及治疗为一体(Radiotheranostic)的治疗方案。利用全球领先的阿尔法核素211At–砹技术,实现癌症精准医疗,为广大患者带来新的希望。
联系方式:
18902207829/weibin.zhuo@astathera.com

点击“阅读原文”查看文献原文


